Metan (CH4) là một loại khí tự nhiên vô cùng quan trọng và có tầm ảnh hưởng đáng kể đến môi trường và cuộc sống con người. Trong bài viết này, chúng ta sẽ khám phá tính chất vật lý, hóa học và ứng dụng của metan trong đời sống hàng ngày.
Metan (CH4) là gì?

Metan (CH4) là hợp chất hữu cơ đơn giản nhất và là thành phần chính của khí tự nhiên. Nó được gọi là “khí metan”, không màu, không mùi, không độc và ít tan trong nước. Cấu trúc của nó là một nguyên tử carbon liên kết với bốn nguyên tử hydro, tạo thành hình tứ diện đều.
Metan là một nguồn nhiên liệu quan trọng và được sử dụng phổ biến trong nhiều ứng dụng, từ công nghiệp đến gia đình. Nó được xem là nguồn năng lượng sạch hơn so với các nhiên liệu hóa thạch khác vì khi cháy, metan thải ra ít khí ô nhiễm và khí nhà kính.
Ngoài ra, metan còn là một nguyên liệu quan trọng trong ngành hóa học, được dùng để sản xuất nhiều sản phẩm hữu ích, như etylen (C2H4) và metanol (CH3OH).
Xem thêm : Tìm hiểu về Cỏ Vetiver: Công dụng, ứng dụng và cách trồng
Tính chất vật lý của Metan (CH4)

Dưới đây là một số tính chất vật lý quan trọng của metan:
- Trạng thái vật lý: Metan là một khí ở điều kiện tiêu chuẩn, có nghĩa là ở nhiệt độ và áp suất tiêu chuẩn (25°C và 1 atm).
- Màu sắc và mùi: Metan là một khí không màu và không mùi. Điều này làm cho nó khó nhận biết bằng các giác quan thông thường.
- Trọng lượng riêng: Trọng lượng riêng của metan là khoảng 0,717 kg/m3 ở điều kiện tiêu chuẩn. Điều này khiến nó nhẹ hơn không khí và dễ dàng bay lên trong môi trường.
- Điểm nóng chảy và điểm sôi: Điểm nóng chảy của metan là -182,5°C và điểm sôi là -161,5°C ở áp suất tiêu chuẩn. Điều này cho thấy metan tồn tại dưới dạng khí ở nhiệt độ và áp suất phổ biến.
- Độ hòa tan: Metan khá ít hòa tan trong nước. Trong điều kiện tiêu chuẩn, một lít nước chỉ có thể hòa tan khoảng 0,02 g metan.
- Độc tính: Metan không phải là một chất độc đại cho con người. Tuy nhiên, nếu metan tụ lại trong không gian hẹp mà không có đủ không khí tươi cung cấp, nó có thể tạo ra một môi trường giàu metan, gây nguy hiểm về cháy nổ.
- Dẫn điện: CH4 không có tính dẫn điện.
Các tính chất vật lý của metan có thể thay đổi tùy thuộc vào nhiệt độ và áp suất. Trên thực tế, metan có thể tồn tại dưới dạng lỏng hoặc rắn ở nhiệt độ và áp suất thích hợp.
Tính chất hóa học của Metan (CH4)

Dưới đây là một số tính chất hóa học quan trọng của metan (CH4):
- Độ bền hóa học: Metan là một hợp chất hữu cơ khá ổn định. Nó không dễ bị oxi hóa hoặc phân hủy trong điều kiện thông thường. Tuy nhiên, metan có thể phản ứng với các chất oxi hoá mạnh, như trong quá trình cháy.
- Phản ứng cháy: Metan là một chất cháy tốt và phản ứng với oxi trong không khí để tạo thành nước (H2O) và khí cacbon đioxit (CO2). Quá trình này giải phóng nhiệt lượng, làm cho metan trở thành một nguồn nhiên liệu quan trọng.
2CH4 + 4O2 → 2CO2 + 2H2O
- Halogen hóa: Metan có thể phản ứng với các halogen (ví dụ như clor, brom) để tạo thành các dẫn xuất halogen của metan. Quá trình này có thể xảy ra thông qua cơ chế thế hợp hoặc phản ứng phân cực. Ví dụ, khi metan phản ứng với clor, sẽ tạo thành clorua metan (CH3Cl).
CH4 + Cl2 → CH3Cl + HCl
- Sản xuất hợp chất hữu cơ khác: Metan có thể được sử dụng làm nguyên liệu cho các quá trình tổng hợp hóa học để sản xuất các hợp chất hữu cơ khác, chẳng hạn như metanol (CH3OH) hoặc etylen (C2H4).
- Phản ứng oxi hóa: Metan có thể phản ứng với oxi trong điều kiện vô cơ hoặc ở nhiệt độ và áp suất cao để tạo ra các hợp chất hữu cơ phức tạp hơn. Ví dụ, trong điều kiện thích hợp, metan có thể oxi hóa để tạo ra formaldehyde (CH2O) hoặc axit axetic (CH3COOH).
CH4 có phân cực không? CH4 là liên kết gì?
Metan (CH4) không phân cực. Mặc dù các liên kết giữa carbon và hydro có tính phân cực nhẹ, nhưng do cấu trúc đối xứng của phân tử, các lực phân cực này cân bằng nhau. Metan là một liên kết cộng hóa trị, nơi carbon và hydro chia sẻ electron để tạo ra liên kết bền vững.
Ứng dụng của Metan trong đời sống của con người

Metan (CH4) có nhiều ứng dụng quan trọng trong đời sống con người. Dưới đây là một số ví dụ về ứng dụng của metan:
- Nguồn năng lượng: Metan là một nguồn năng lượng quan trọng. Nó được sử dụng rộng rãi như một nhiên liệu trong ngành công nghiệp và gia đình. Metan có thể được đốt để tạo ra nhiệt và điện, và nó được sử dụng trong các nhà máy điện, nhà máy luyện kim, và hệ thống sưởi.
- Nhiên liệu giao thông: Metan được sử dụng làm nhiên liệu cho các phương tiện giao thông. Trong dạng nén (CNG – compressed natural gas), metan là một nguồn năng lượng sạch và thân thiện với môi trường. Nó được sử dụng trong xe ô tô, xe buýt, và các phương tiện khác để giảm khí thải gây ô nhiễm và khí nhà kính.
- Dùng trong công nghiệp hóa chất: Metan là nguyên liệu quan trọng để sản xuất các hợp chất hữu cơ khác. Nó được sử dụng để sản xuất metanol (CH3OH), etylen (C2H4), axit axetic (CH3COOH), và nhiều hợp chất hữu cơ khác. Các sản phẩm này có ứng dụng rộng rãi trong ngành công nghiệp hóa chất, dược phẩm, nhựa, và một số ngành công nghiệp khác.
- Sử dụng trong gia đình: Metan cũng có ứng dụng trong gia đình. Nó được sử dụng làm nhiên liệu cho bếp, máy sưởi, và máy phát điện trong nhiều hộ gia đình trên toàn thế giới. Metan là một nguồn năng lượng hiệu quả và giúp giảm chi phí năng lượng trong ngôi nhà.
- Sản xuất khí tự nhiên: Metan là thành phần chính của khí tự nhiên. Khí tự nhiên được sử dụng rộng rãi như một nguồn năng lượng và là nguồn cung cấp chính cho các ứng dụng năng lượng trên toàn thế giới.
Khí metan có ở đâu trong thiên nhiên?

Khí metan (CH4) tồn tại tự nhiên trong nhiều nguồn khác nhau trên Trái đất. Dưới đây là một số nguồn chính của khí metan trong thiên nhiên:
- Mỏ dầu khí và mỏ khí tự nhiên: Mỏ dầu khí và mỏ khí tự nhiên là các nguồn chính của khí metan. Nó được tạo ra từ quá trình hóa thạch hữu cơ hàng triệu năm trong lòng đất. Khi các tầng đất chứa dầu mỏ hoặc khí tự nhiên bị mở, khí metan được giải phóng và khai thác để sử dụng làm nhiên liệu hoặc nguồn năng lượng.
- Các hệ thống sinh vật nước: Khí metan được tạo ra trong các môi trường sinh vật nước, chẳng hạn như hồ, sông, đầm lầy, và đầm phá. Quá trình hủy sinh vật chất hữu cơ trong môi trường thiếu oxi tạo ra metan thông qua quá trình biến đổi gọi là phân hủy methanogenic.
- Ruộng nương, ao nuôi, và các vùng đất nông nghiệp: Trong các khu vực nông nghiệp, sự phân hủy các chất hữu cơ trong đất, phân bón, và phân của động vật tạo ra khí metan. Nước ngập, như trong ruộng lúa và ao nuôi, tạo ra một môi trường phù hợp cho vi khuẩn methanogenic phát triển và sản xuất metan.
- Nguồn metan biển: Biển cũng là một nguồn tiềm năng của khí metan. Các khu vực biển sâu và đáy biển có thể chứa khí metan bị khóa trong dạng hydrate metan (một dạng băng metan). Khi có sự tác động, chẳng hạn như sự biến động của áp suất và nhiệt độ, hydrate metan có thể phân hủy và giải phóng metan vào môi trường.
Khí metan tồn tại tự nhiên trong khí quyển và có tác động mạnh đến hiệu ứng nhà kính và biến đổi khí hậu. Metan là một khí nhà kính mạnh gấp khoảng 25 lần so với CO2, tuy nhiên, nó có thời gian tồn tại ngắn hơn trong khí quyển.
Cách điều chế khí metan (CH4) trong phòng thí nghiệm
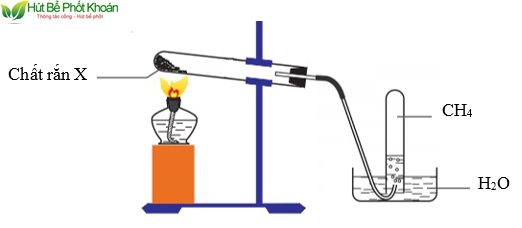
Metan (CH4) có thể được sản xuất trong phòng thí nghiệm thông qua một số phương pháp. Dưới đây là hai phương pháp chính để sản xuất metan trong môi trường phòng thí nghiệm:
- Phản ứng giữa axit và chất kiềm:
- Bước 1: Chuẩn bị một dung dịch axit đậm đặc như axit clohidric (HCl) hoặc axit sunfuric (H2SO4) trong một bình đựng.
- Bước 2: Thêm một chất kiềm như hydroxit natri (NaOH) hoặc hydroxit kali (KOH) vào dung dịch axit.
- Bước 3: Quan sát và thu thập khí metan thoát ra từ phản ứng giữa axit và chất kiềm. Điều kiện và phương pháp thu thập có thể thay đổi tùy thuộc vào yêu cầu cụ thể của phòng thí nghiệm.
- Phản ứng giữa hydrocacbon và chất kiềm:
- Bước 1: Chuẩn bị một chất hydrocacbon như metanol (CH3OH) hoặc etanol (C2H5OH) trong một bình đựng.
- Bước 2: Thêm một chất kiềm như hydroxit natri (NaOH) hoặc hydroxit kali (KOH) vào chất hydrocacbon.
- Bước 3: Hâm nóng hỗn hợp và quan sát và thu thập khí metan thoát ra từ phản ứng giữa hydrocacbon và chất kiềm.
Trong cả hai phương pháp trên, khí metan sẽ được thu thập thông qua một hệ thống thu hồi khí hoặc thu hồi bằng nước. Quan trọng là thực hiện các biện pháp an toàn, bao gồm làm việc trong không gian thông gió tốt, đảm bảo an toàn khi xử lý axit và chất kiềm, và giữ khoảng cách an toàn khi làm việc với nguồn nhiệt.
Metan có hại không?

Khí metan không phải là một chất độc đại cho con người và không gây hại trực tiếp khi hít thở trong môi trường thông gió. Tuy nhiên, khí metan có một số tác động tiềm ẩn và tác động lớn đối với môi trường và khí quyển. Dưới đây là một số tác hại của khí metan:
- Hiệu ứng nhà kính: Khí metan là một khí nhà kính mạnh, có khả năng giữ lại nhiệt và làm tăng nhiệt độ trái đất. Khi thoát ra môi trường từ các nguồn như mỏ khí tự nhiên, hệ thống sinh vật nước, và hoạt động nông nghiệp, khí metan góp phần vào tăng hiệu ứng nhà kính và biến đổi khí hậu toàn cầu.
- Ô nhiễm không khí nội đô: Trong các khu đô thị và thành phố lớn, khí metan có thể được tạo ra từ các nguồn như bãi rác, nhà máy xử lý chất thải, và hệ thống cấp nước và thoát nước. Khi metan thoát ra môi trường mà không được kiểm soát, nó có thể tạo ra một môi trường nguy hiểm và gây ô nhiễm không khí trong không gian hẹp, gây nguy hiểm đối với sức khỏe con người.
- Tác động đến lớp ozone: Metan có thể tác động tiêu cực đến lớp ozone trong tầng bình lưu stratosphere. Khi metan tương tác với các hợp chất khác trong tầng stratosphere, nó có thể góp phần vào quá trình phá hủy lớp ozone, làm gia tăng tầng ozon mỏng và gây hiện tượng “hố ozon”.
- Nguy cơ cháy nổ: Mặc dù metan không độc đại, nó có thể tạo ra một môi trường dễ cháy. Trong không gian hẹp, nếu metan tụ lại mà không có đủ không khí tươi, nó có thể tạo ra một môi trường giàu metan và tạo nguy cơ cháy nổ và bức xạ nhiệt.
Metan có tác động gì đến sức khỏe con người?
Khí metan không phải là chất độc đại trực tiếp cho con người và không gây hại khi hít thở trong môi trường thông gió. Tuy nhiên, trong không gian hẹp và thiếu thông gió, metan có thể tạo ra một môi trường dễ cháy và gây nguy cơ cháy nổ và bức xạ nhiệt. Ngoài ra, khi metan không được kiểm soát và xử lý đúng cách, nó có thể góp phần vào ô nhiễm không khí nội đô và tác động tiêu cực đến môi trường.


Để lại một bình luận